根据近年来国家药品监督管理局发布的飞行检查结果,不少企业就是因为仪器的数据完整性不符合要求,导致相关药品GMP证书被收回,造成巨大的经济损失和社会不良影响。我们将发现的数据完整性问题总结为以下几类:
-
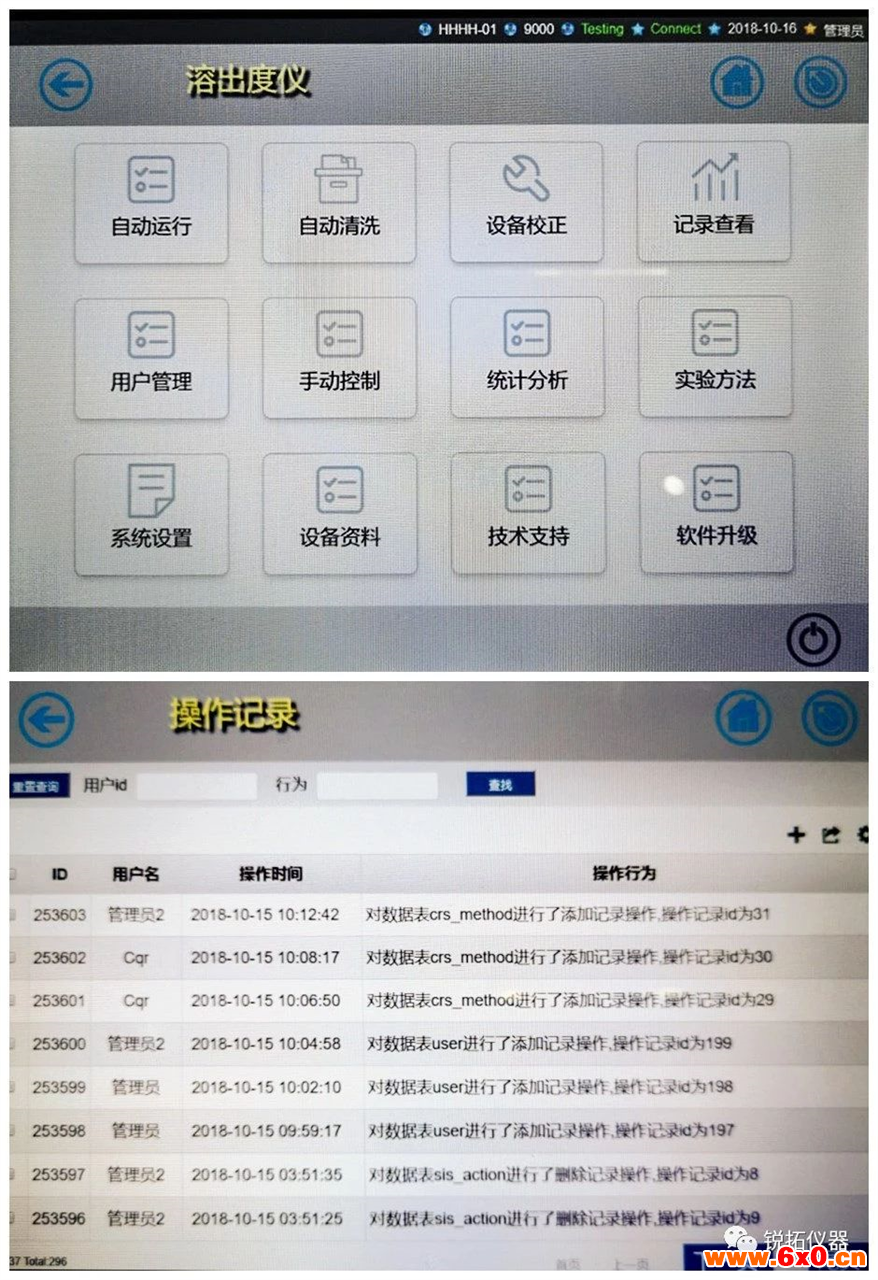
仪器没有用户权限管理程序,或权限管理不合理
如编号为CNGZ20180010的调查报告中提到,某企业的计算机化分析仪器未建立人员登录、使用、授权、取消、变更的程序。未规定质量受权人(质量负责人)、QC室主任和操作人员权限。
-
仪器的关键记录及数据未保存导致无法溯源,数据没有定期异地备份
如编号为CNFX20170006的调查报告中提到,该企业的实验数据未定期异地备份和存档,存在新数据覆盖旧数据的现象,不能溯源。
-
选择性使用电子数据,数据可以被随意删除或捏造
如编号为CNGZ20180012的调查报告中提到,某企业执行测试时,因前两次的测试结果与预期不符,检验员直接将该两次结果遗弃而未进行调查。且该企业的实验员有权限对其实验室内关键分析仪器的数据进行删除。
-
仪器产生的测试数据存在严重逻辑错误,数据存在真实性问题
如编号为CNFX20170002的调查报告中提到,某企业执行测试时,样品数据打印时间比样品实验时间还早(即样品没开始测试就已经有结果输出),存在严重的时间逻辑错误。
-
有严格的计算机化系统人员权限管理制度,如:
(1)控制访问:只有经许可的人员才能进入和使用系统。
(2)分配权限:就进入和使用系统制订授权、取消以及授权变更的操作规程。
(3)记录异常:应当考虑系统能记录未经许可的人员试图访问系统的行为。
-
仪器产生的关键记录及数据均有被完整记录,定期对数据进行异地备份,且备份的数据可以确认与原始数据一致。
-
仪器有完整的计算机系统审计追踪功能,能够连续记录整个测试流程中每个操作人员在每个时刻的每个操作,并能够完整地输出审计追踪。审计追踪功能不可被关闭。在样品测试结果放行前,应该完成审计追踪记录的审阅,确认测试过程中没有出现不符合数据完整性要求的行为。
-
所有删除数据和修改时间的权限均应该被禁止。仪器应该能够设定各种用户权限,能够预防数据完整性缺陷发生。
-
加强对仪器供应商的管理,应当针对计算机化系统供应商的管理制定操作规程。供应商提供产品或服务应该符合数据完整性的要求,能够提供计算机系统验证的技术支持。应该有适当的专业人员,对计算机化系统的设计、验证、安装和运行等方面进行培训和指导。
所有监管部门都一致认为,数据完整性必须贯穿从药物研发到药物退市的整个产品生命周期,必须保证产品生命周期内所有GXP数据的真实可靠。
由此可见,一台符合数据完整性的溶出度仪将很好地助力企业通过各种日趋严格的审查。而锐拓,作为一家能够做到真正的数据完整性的溶出度仪生产厂商,有信心为用户提供完全符合法规要求的产品和服务。

锐拓RT-612溶出仪是符合数据完整性、支持审计追踪的溶出仪,采用共轴分体式搅拌装置、杯口包覆式溶出杯设计,实现自动同步投药、自动取样、自动补液、自动排空管路等功能,让溶出实验更、更智能、更。










 QQ交流群
QQ交流群

