
小奥课堂又来啦!
这一次干货满满哟,
快来看看ELISA在生物药研发中的直接法实验方案吧!
一、前言
ELISA在生物药物研发的各个环节均有广泛的应用:
如以生物大分子检测为目的,在药效药代评估时,对动物实验和临床实验中的血液样品的药物浓度和生物大分子标志物进行定量检测;
以亲和力测定为目的,在质量分析过程中,对抗体相对于靶点抗原的亲和力检测;
以亲和力筛选为目的,在抗体发现过程中,对杂交瘤细胞克隆上清分泌抗体相对于靶点抗原的亲和力大小进行区分等。
使用目的不同,则需要选取不同特性试剂耗材。
参差多态方显世界精彩,ELISA方法学开发也是一个道理。
本篇为ELISA方法开发构建的的几大实例之一——生物大分子检测的定量方法开发的具体实验方案,适用于所有初接触ELISA方法技术且有志于进行ELISA方法开发建立的同仁。
有多精彩,且往下看:
二、ELISA定量方法的类型和构架
采用ELISA技术进行定量的平台化方法——一般来说可以分为两类,即间接法和直接法。
间接法也称为竞争法,直接法也称双抗夹心法。
今天,我们重点为大家介绍直接法。
直接法以定量抗原为例:
首先,以与抗原有强亲和力的抗体包被固定在酶标板材上,加入抗原标准品/样品反应,再加入与抗原有强亲和力的抗体并且偶联了辣根过氧化氢酶HRP/碱性磷酸酶AP的酶联抗体反应,后加入酶对应的底物显色,中间通过洗涤去除反应体系中未结上的试剂成分。
这样信号大小和抗原的浓度成正相关,随着反应的进行酶标板材上固定的成分由抗体,转变为抗体-抗原,后变为抗体-抗原-酶联抗体,待测的抗原处于两个抗体之间,所以也称为双抗夹心法。
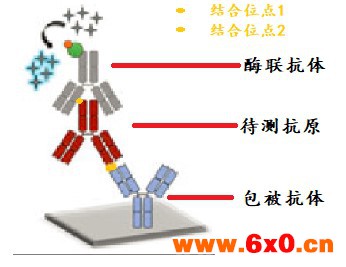
双抗夹心法有一个关键点:待检测的物质(如抗原)必须给包被抗体和酶联抗体提供两个结合位点,这两个位点可以是抗原上两个以上相同的结构位点,也可以是不同的结构位点。
一般来说,Elisa的构架由标准品,内控品,对照,基质对照和待测样品组成。
标准品
根据实验的具体应用方向来源,标准品可以是已知浓度的/国家标准品或者商业化的已知浓度的蛋白分子,也可以是自制的以其他方式定量(如紫外吸收定量)的纯度较高的蛋白分子。标准品一般为7-8个浓度点,拟合成合适的浓度-信号剂量曲线作为标准曲线进行内控品和样品的定量。
内控品
其中,内控品是能够使用的、独立分装的、特定浓度(高中低)的标准品,是监控ELISA实验在单次实验中的质量和的应用过程中不同批次标准品的过渡桥接。
对照
对照为不含标准品的标准品溶液,基质对照则为不含样品的样品溶液——两者可能是一样的成分,也可能是不同的成分,需要根据实验的具体情况进行区分,目的是确认ELISA体系中是否有非异的交叉反应。

三、ELISA实验:你的耗材试剂选对了吗?
成功的ELISA方法的开发关键,在于对ELISA实验中所使用的试剂耗材的选择和搭配。
对试剂耗材的特性和多样性的了解,有助于在不同的实验需求中寻找合适的组合搭配中开发高质量的ELISA方法。
①酶标板材:
市面上提供的酶标板材基本都是多聚苯乙烯,产品线比较齐全的公司会对多聚苯乙烯材质的多种化学修饰以相对于包被的蛋白具有不同的特性。
一般的酶标板材的说明书上会根据高结合力(Highbinding),中结合力(mediumbinding)的维度进行划分。
但笔者以多年的从业经验出发,会更信任以亲水,弱亲水,未处理和疏水四个等级划分酶标板材的类型和特性的酶标板材。
一般来说,酶标板材由亲水到疏水,对蛋白的结合会由强逐渐变弱,这会带来三个效果:
相同浓度的蛋白包被,结合能力强的比结合能力弱的材料可以在酶标板材上固定更多的蛋白,因为单孔亲水板材的吸附抗体量是220ng,而疏水板材只有100ng。
由亲水到疏水,板材对包被蛋白的吸附效率提高的同时,其对ELISA反应过程中样品蛋白、样品溶液中的其他蛋白和酶联抗体的非特异吸附的能力也会提高,从而造成非特异信号。
包被的蛋白作为一个大分子以一个表面吸附在酶标板材上,其表面在不同酶标板材上并不是大多数人想象中的随机均匀的,有明显的偏向性,会导致在不同的特性酶标板材上,包被蛋白与酶标板材的接触表面不一样,从而造成不同的位点被屏蔽的现象。如果这个位点恰好是与检测样品结合的位点,样品将会因此无法被检测到。
所以一个专注多样化ELISA方法开发的实验室应该准备多种不同特性的酶标板材以供选择。
②包被液:
常用的包被液是PBS(pH 7.4)或者碳酸钠-碳酸氢钠溶液pH 9.6,pH和离子浓度会对包被的效率产生一定的影响,需根据包被蛋白的特性进行具体分析,包被蛋白溶液经过包被后也不会都吸附在酶标板材上,包被完成后大部分蛋白还是留在溶液中。
文献中有记载蛋白溶于包被液后抽真空使包被蛋白以更高的密度吸附在酶标板材上的案例。
③封闭剂:常用的封闭剂有3%BSA(w/v),5%脱脂奶粉(w/v)等。
封闭液的作用是覆盖酶标板材包被蛋白占据位置以外的空间,以抵抗后续样品或者样品中的其他物质、酶联抗体等对于板材直接的非特异吸附。
根据笔者多年的实践经验,封闭剂只能对成分简单的样品溶液起到较好的封闭作用但面对成分比较复杂的样品溶液,封闭效果则会大打折扣。
有研究表明,封闭剂的封闭效果和封闭分子的大小成反比,所以如果传统的封闭剂起不到很好的封闭效果,选用分子量更小的封闭剂(如:酪蛋白),可能会取得更好的封闭效果。
另外需特别注意:如果检测体系是生物素-链霉亲和素体系,千万不要使用脱脂奶粉作为封闭剂——因为脱脂奶粉中含有生物素,会对检测体系造成干扰。
④洗涤液/稀释液:
常用的洗涤液是中性的缓冲液加上一定浓度的去污剂如PBST (0.05%(V/V) Tween-20 in PBS)。
稀释液会在洗涤液中加入一定的封闭剂成分如0.5%BSA (W/V ) in PBST。
在一些体内样品的检测过程中,通常会在稀释液中加入一定浓度的阴性血清,以使得不同稀释度的样品有相同的非特异背景。
⑤酶联抗体:
酶联抗体的种类很多,可根据抗体的作用位点分为特异性酶联抗体和通用型酶联抗体。
特异性酶联抗体作用于特定蛋白的表位上。
通用型酶联抗体则往往针对于多肽序列组成的标签,生物素,特定种属抗体的Fc端保守区域等。
常用的酶联抗体标记的酶主要为AP(碱性磷酸酶)和HRP(辣根过氧化氢酶)。
酶联抗体根据其抗体的成分可分为单抗酶联抗体和多抗酶联抗体。
其中多抗酶联抗体的多抗成分一般是通过免疫兔或者山羊得到的,成分比较复杂,需格外注意其与ELISA体系中其他试剂的交叉反应。
酶联抗体根据其抗体的分子量由大到小可分为全长的酶联抗体、Fab片段酶联抗体、scFv酶联抗体。
分子量越小的酶联抗体越有可能避免和样品蛋白结合时可能存在的作用位点被空间阻碍的情况,但也进一步增加了酶联抗体绕过封闭剂的阻断与酶标板材进行非特异结合的风险。
⑥显色液和酶标仪:
显色液的选择需与酶联抗体的酶对应,也需和实验室所具备的酶标仪对应。
如酶联抗体偶联的是HRP(辣根过氧化氢酶),可以采用TMB显色液,用能够进行吸光度读数的酶标仪进行检测;
或者Ampliflu™Red为底物,用能够进行荧光读数的酶标仪进行检测;亦或采用QuantaRedADHP为底物,用能够进行化学发光读数的酶标仪进行检测。
一般来说,ELISA方法的灵敏度会受到底物的检测方法限制,化学发光底物能够检测的信号下限要优于荧光底物,再优于吸光度值底物。
即使是常用的TMB显色液,很多供应商不同显色强度的显色液,可以根据方法开发过程的具体情况合理选择显色液。
四、ELISA定量方法学开发实际案例分析
布局
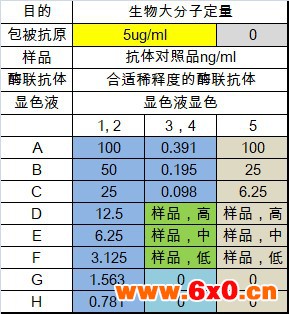
布局说明
增加了未包被(灰色)的分组,此分组是很有必要的,目的是为了确认待检测的样品或者对照品物质对酶标板材的非特异吸附。
样品进行低中高稀释,用来检测样品相对于对照品的平行性,即样品和对照品在相同的ELISA体系中是否具备相同的免疫学特性。
如果低中高样品的信号值在标准曲线合理的定量范围内,低中高样品经稀释倍数校正后的三组浓度值接近,说明样品和对照品平行性较好,平行性较差则该样品的检测不能用该对照品作为标准曲线。
一般操作流程
01
酶标板的制备:取浓度为100 ug/ml抗体,室温溶解,混匀用包被液按如下步骤稀释至5ug/ml,按加样布局表加入100ml/孔,分别加入酶标板条中 (Note 1),其中加入包被液做包被抗体的对照,2-8℃过夜。
02
用洗涤液洗板3次,拍干,加入300ml/孔封闭液(Note 2)室温封闭1小时;洗涤液洗板3次,拍干待用;
03
抗体对照品的梯度稀释和样品的高中低稀释(Note 3),100ul/孔加入微孔板中标准品稀释。
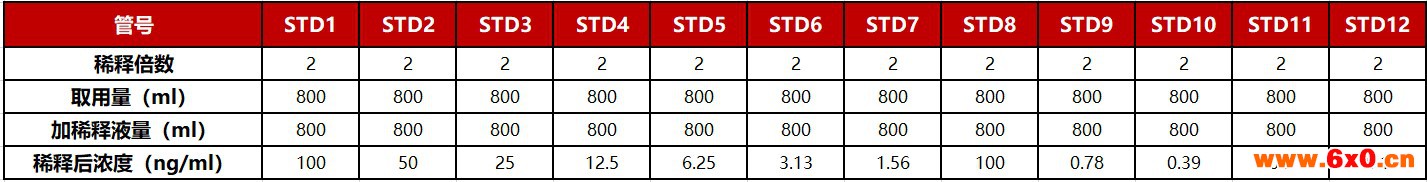
04
放入奥豪斯微孔板振荡器内,设置37℃、600rpm振荡1小时;

05
用洗涤液洗板3次,拍干;
06
酶联抗体稀释到合适的浓度(Note 4),在奥豪斯漩涡混合器上混匀,100ul/孔。

07
放入微孔板振荡器内,设置37℃、600rpm振荡1小时;
08
用洗涤液洗板4次,拍干;
09
取酶联抗体对应的显色液,临用前20分钟拿出平衡到室温,在漩涡混合器上混匀;
10
使用8道排枪以100 ml/孔加入显色液;
11
显色液室温避光放置10-30分钟(Note 5)
12
使用8道排枪以100ml/孔加入终止液终止反应;(根据底物的不同,此步可能不需要)
13
用酶标仪测定信号值;(Note 6)
14
结果分析(Note 7)
贴心的Note说明-经验总结
Note1:在包被过程中如果需要减少整个ELISA体系试剂对酶标板材的非特异吸附,建议选择疏水性酶标板材(polysorp),包被的抗体浓度要足量2-5ug/ul。
Note2:封闭液不一定能起到封闭效果,需要实验验证(未包被抗原的分组),一般来讲分子量越小的封闭剂效果越佳。
Note3:在方法学开发的初期可以拉大一下标准曲线的浓度范围1000ng/ml-0.1ng/ml。
Note4:酶联抗体的稀释需要做不同的稀释度进行比较选择,对于单抗成分的酶联抗体如果高低两个稀释度的酶联抗体能够产生一样的剂量曲线,说明酶联抗体过量,ELISA的信号传递未产生偏差。对于多抗成分的酶联抗体,其稀释度的判断较为复杂,可以根据标准曲线的浓度时的回测来判断酶联抗体浓度是否合适,如果对照品较高浓度的两个点信号值接近,说明多抗酶联抗体的浓度过低。
Note 5:对于吸光度值底物和荧光底物,仪器检测的信号值和显色时间成正比,控制在10-30分钟为宜。需要提前确认检测仪器的信号线性范围,比如一般的酶标仪吸光度值的信号线性范围在0-3,吸光度值在3-4之间为非线性的,在显色时应控制信号值不要超过3,或者将信号值大于3的点不列入标准曲线的拟合。
Note 6:不同底物需要用不同的仪器进行检测,吸光度读值,荧光读值,化学发光读值。在底物选择过程中注意实验室的酶标仪是否具备该种类型的读数功能。
Note 7:标准曲线的剂量曲线拟合可以是线性的,对数线性或者四参数拟合,检验标准是标准曲线各浓度点的回测偏差小于20%,如果不符合,删除浓度点,直至符合标准。
五、总结
仪器的检测信号的线性范围是有限的,如TMB显色液的信号的线性范围在0-3,ELISA方法开发和优化过程更多时候是对于对照品的信号值的控制和调整,以使得信号值在线性范围内。
使用增强型的TMB显色,延长显色时间,增加标准曲线的浓度点,增加酶联抗体的浓度等增强信号值,反之能够降低信号值。
在信号值的线性范围有限的情况下,尽可能的消除非特异吸附的信号值是方法灵敏的关键之一,选用疏水性酶标板材,采用分子量更小的封闭剂,采用相对简单单抗酶联抗体或者链霉亲和素酶联抗体等都是有效消除非特异吸附信号的形式。
在ELISA方法学开发过程中多样化的试剂耗材的合理选择和搭配是一个稳定,灵敏的ELISA方法的关键,而多样化试剂材料的特性的了解是选择的关键,这个需要在对比实验中根据信号的变化系统的去了解和剖析。
- 参考资料 -
1. ELISA技术应用概览和方法学开发初析
有助于宏观把握ELISA定量方法开发的原理
2. Decker J , Reischl U , Butler J E . SolidSupports in Enzyme-linked Immunosorbent Assay and Other Solid-PhaseImmunoassays[M]// Molecular Diagnosis of Infectious Diseases. Humana Press,2004.
非常有用的ELISA综述,有利于了解ELISA的各个环节。
3. Desilva B , Smith W , Weiner R , et al. Recommendations forthe Bioanalytical Method Validation of Ligand-Binding Assays to SupportPharmacokinetic Assessments of Macromolecules[J]. Pharmaceutical Research(Dordrecht), 2003, 20(11):1885-1900.
ELISA定量方法系统的方法学验证过程介绍,有助于对ELISA方法的优劣进行评估
4. Findlay J W A , Dillard R F . Appropriate calibration curvefitting in ligand binding assays[J]. Aaps Journal, 2007, 9(2):E260-E267.
ELISA标准曲线不同函数进行拟合的比较文章。
5. Cox K L , Devanarayan V , Kriauciunas A , et al. ImmunoassayMethods[J]. 2012.
类似此篇文章的英文实验手册,可以借鉴学习下。
6. Pillutla R C . Book review: ligand-binding assays:development, validation and implementation in the drug development arena.[J].Bioanalysis, 2011, 3(3):271-273.
非常有用关于ELISA定量方法(ligand-binding assay)各个方面的书籍,有利于加深学习。










 QQ交流群
QQ交流群

