传统的菌种保存方式简介
• 斜面保存法:微生物保存基本的方法,可广泛用于细菌、真菌等,保存期限非常短,斜面容易干裂。
• 液体石蜡保存法:可用于保存霉菌、酵母菌、放线菌及需氧菌,方法简便,可防止斜面干燥和氧气进入,但一些固氮菌、分枝杆菌、毛霉、厌氧菌等不适宜用此法。
• 甘油冷冻保存法:用于一般细菌的保存,需使甘油终浓度为20%左右,然后-20℃或-70℃以下保存。融化时需要水浴溶化。
• 真空冷冻保存法:具有低温、干燥、无氧的保存条件,适用于98%以上菌种的保存,但操作复杂,一般实验室难以使用。
• 液氮保存法:基本所有微生物均可保存,并且保存时间长,但操作较为复杂而且需要设备,不适用于一般实验室保存菌种。
• 沙土保存法
• 半固体保存法
瓷珠菌种保存法的原理
瓷珠菌种保存管是实验室保存菌种的容器,管内有表面凹孔小瓷珠用于细菌的吸附和保存,放置于-20℃或-80℃下便可创造干燥、低温、缺营养的环境,使菌株处于“休眠” 状态,方可长期保存(视不同菌种与保存温度,一般可保存3-10 年), 同时菌种保存管的取用和保存较为便利(取用复苏及保存菌种仅需1分钟)。

瓷珠菌种保存管的优点
• 用途:菌种保存、复苏和运输。
• 优点:操作简单方便、菌种保存快速、包装物体积小、菌种保存时间长。
• 操作简单方便:挑取细菌新鲜纯培养物,接入菌种保存管。
• 菌种保存快速:混匀后,吸出冷冻保存液。
• 包装物体积小:1.8ml冷冻管。
• 菌种保存时间长:2-8℃可保存6个月;-20℃可保存12个月;-80℃可保存24个月。
瓷珠菌种保存管的使用方法
菌种保存流程
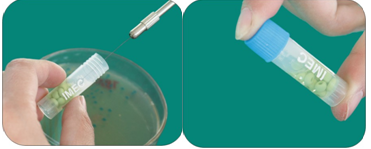

1.从培养18h以上的平板上刮去新鲜纯培养物于菌种保存管中,配成大约3-4麦氏比浊度的菌悬液。
2.拧紧保存管,来回颠倒几次使细菌乳化,不能旋摇。
3.用无菌移液器将菌种保存管内的液体吸取干净,妥善放置被吸出的液体。
4.拧紧保存管,迅速将其置于-20℃或-70℃冰箱中。
使用时的注意事项
• 被保存的菌种要求是经过纯化后培养 18-24h 内的新鲜菌种(细菌18-24h,酵母菌需3 天,形成孢子的微生物保存孢子,而放线菌和丝状真菌需培养7 天后保存),不宜使用老化或未经鉴定的菌种。
• 菌种保存浓度必须要做3-4 麦氏比浊度,如接种浓度过低将会降低复苏效果。
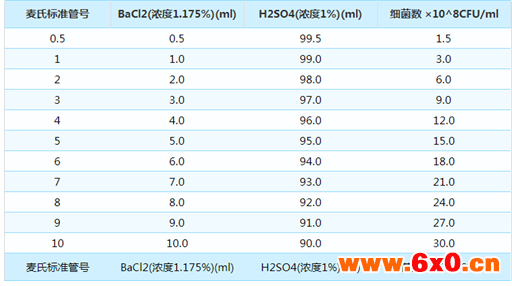
• 待保存于菌种保存管中的菌种完全乳化均匀吸附在多孔小瓷珠后,要将多余的菌种保存液吸取出来并弃之,否则在复苏时的冻融过程中会损伤菌株活性。
• 做厌氧菌保存时,应提供厌氧的环境,如厌氧箱、厌氧袋,菌种保存管中可通入氮气来驱除保存菌种时所引入的氧气。菌种复苏时,也要创造厌氧的环境。
• 菌种复苏完成后,对使用菌株需要进行再次纯化,以保证菌株的单一性。
常见问题答疑
1、菌种保存管能保存霉菌及酵母菌吗?
答:可以。对于霉菌等真菌需培养7 天进行保存,而酵母菌需培养三天将孢子洗脱下来进行保存,保存管中的小瓷珠可以作为介质来吸附孢子和菌丝,相当于砂土保存法中砂土作为载体起到的作用。
2、所有的菌都能保存吗?如果不是的话,什么样的菌可以保存?什么样的菌不可以保存?
答:可以。菌种保存的原理是预防或减缓DNA 复制时自发突变导致菌种退化,因此要创造代谢不活泼的状态,而菌种保存时使菌种进入休眠态(孢子、芽孢),并创造干燥、低温、缺氧、缺营养的环境,创造的环境越接近此状态,所保存的菌种的时间就越长,所以从原理上讲,所有菌种都可用这种方法保存, 但需要注意的是,苛刻菌(如流感嗜血杆菌、脑膜炎萘瑟氏菌)等特殊细菌保存时,需-80℃或更低温度保存,才可以做到更长期的保存。
3、能用菌种保存管长久保存菌株吗?
答:温度越低,保藏效果越好。从目前的试验数据及实际保存效果来看,-20℃可保存1-5 年,-80℃或液氮中可保存5-10 年,不同菌种及不同的保存温度保存时间会有所不同(例如:大肠、沙门等常规细菌-20℃我们目前可以保存到6年)。但需要注意的是所保存的菌种需每年抽检进行生化特征的鉴定,确定菌株无变异。
4、菌种保藏时为什么要进行分离纯化?
答:分离纯化后才能获得单一菌株,单一菌株进行菌种保藏才有意义,防止菌种交叉污染和变异,这也是菌种保存的基本原则。
5、菌种保存管对于平板来说,对挑选菌落个数有要求吗?还是将整个平板的菌落全部刮入管中?
答:对于要保存的细菌一般是要进行2-3 次的纯化,要保证一个平板上的菌是由单一菌落传代而来的,所以在细菌保存的过程中,为了保证制备的菌悬液可以达到3-4MCF,是可以将整个平板的的细菌全部刮到管中的,如果平板长的比较满一般半个平板就够用,具体用量也根据菌种的不同有所差异,如霉菌、酵母菌在保存时,不适合用浊度法。
6、对于液体培养基培养的纯菌,是否也可以用咱们的菌种保存管?如果可以的话,怎么操作?
答:是可以用的,如果液体培养基能保证是纯菌的话,可以直接离心,弃掉上清,然后把保存管中液体吸进去充分混匀,然后再转移到菌种保存管中,整个过程要注意无菌操作。不过,一般菌种保存管选择平板菌落进行保存,因为液体培养基中有杂菌是不易观察出来的。
7、为什么在菌种保存时,要上下颠倒?为什么不能旋摇?
答:上下颠倒,可使菌悬液充分混匀,菌株充分、均匀地吸附到小瓷珠上,旋摇不利于菌悬液充分混匀,反而会使菌株全部沉淀于管底。
8、为什么在使用时要将管内的液体尽可能多的吸出?
答:吸出液体可避免反复冻融形成的冰晶对菌株的损伤,加快复苏的过程,因此,要尽可能的将与菌种混匀后的保存液吸净。而常用的甘油法,在复苏的过程中需用水浴锅快速溶解,在此过程中,对菌株伤害较大。
9、在使用后,菌种保存管的保存环境?需要-80℃冰箱吗?
答:本公司菌种保存管采用的是低温冷冻保存法,因此,使用后,需放置低温环境,如-20℃、-80℃或液氮中保存,而且温度越低,保存效果越好。用户需根据菌种的保存要求选择具体保存温度。
10、为什么说,如果有条件的话,菌种保存管置于-80 冰箱或液氮中?
答:因为,贮存在-70℃以下低温中能减少冰晶形成,可极大降低冰晶形成对细菌的伤害,同时可为被保存的菌种创造更低的代谢环境,从而延长细菌保存的时间。
11、为什么在取用菌株时,操作过程要求快速?
答:菌种保存复苏的原则,要求慢冻快融,之所以要求快速,是因为在菌种复苏的过程中, 长时间的溶解过程会对所保存的菌种造成损伤,而我们经过改良的保存方法最很程度的避免复苏所造成的影响,但我们还是建议遵循菌种的保存复苏原则,保证所复苏菌种的复苏率。
12、将菌株反复冻存,到底对菌株有什么影响?
答:低温会使菌株细胞内的水分形成冰晶,从而引起细胞结构尤其是细胞膜的损伤。细胞体积大者一般要比较小者对低温更为敏感,而无细胞壁者则比有细胞壁者敏感。如果放到低温(不是一般冰箱)进行冷冻时,会产生冰晶,冰晶呈针状,极易导致细菌的严重损伤。用电镜观察,可见细菌的核膜上有大量针尖样小孔,当从低温下移出并开始升温时,冰晶又会变大,故反复冻存,会对菌株造成极大损伤。
13、为什么有时候菌种的保存效果不佳?
答:1、可能是由于保存后未将保存液吸尽,反复冻融形成冰晶损伤菌株细胞,影响了菌株活性。
2、确定所保存的菌种是否为对数生长期的菌种,我们建议普通菌种保存为18小时内的新鲜菌种,而霉菌需要待孢子出现后保存其孢子。
14、该产品能否用于菌种的运送,如果可以在什么条件下运送?
答:就目前试验数据而言,我们建议可主要用于普通细菌的短期运送,对于厌氧菌在运送时让其处于厌氧环境下,2-8℃运送不超过5 天。另外需要说明的是如弧菌属和绿脓杆菌需要常温运送,其对2-8℃温度极其敏感。











 QQ交流群
QQ交流群

