
上期小奥课堂和大家讲了《ELISA方法学开发实践版-生物大分子检测的定量方法开发》。
本期小奥再和大家分享另一个重要话题:《ELISA方法学开发实践版-亲和力测定方法开发》。
一、前言
目前用于测定受体配体间的亲和力,也就是解离平衡常数的方法,主要有:
- 热力学测定方法
- 动力学测定方法
- 饱和浓度法
其中动力学测定方法和饱和浓度法较为通用:动力学测定方法(如Biacore)涉及到比较昂贵的仪器投入,饱和浓度测定法为国内绝大多数生物药物企业常用的测定方法。
ELISA用于亲和力的测定是饱和浓度测定法的主流模式,常用于抗原蛋白或者抗体的蛋白水平的活性评估和抗体的稳定性评价等。
ELISA用于亲和力测定往往没有商业化的试剂盒,需要实验人员进行方法学开发。
由于生物技术这方面教育缺失和新药研发企业在此应用的积累不够,一个能够通过方法学验证的ELISA亲和力测定方法对于很多从业人员来说是一件难度较大的事情,而且很有可能出现谬误如新号传递错误或者偏差等。
其中的一个谬用是采取ELISA定量的实验条件进行ELISA亲和力测定方法的开发。
本文从亲和力的测定方法的基本原理入手,描述饱和浓度法亲和力测定的基本原则,概述ELISA方法开发过程中的抗原抗体的剂量关系,以及在ELISA用于亲和力测定方法应用时可能会出现的几个错误,并为大家介绍通用的亲和力测定的方案和初步的方法学开发的方案。
二、亲和力基本概念
我们通过分析几个化学反应案例,和大家解释一下什么叫做亲和力。
例子A
氢气和氧气在点燃的条件下生成水。
在反应停止时,如果在反应环境中氢气的摩尔浓度恰巧是氧气的摩尔浓度的2倍时,两者皆被消耗,反应环境中只有水;如果氢气的摩尔浓度大于氧气的摩尔浓度的2倍时,氧气被消耗,反应环境中只有氢气和水;果氢气的摩尔浓度小于氧气的摩尔浓度的2倍时,氢气被消耗,反应环境中只有氧气和水。
这是关于化学反应的基础知识,化学反应进行的结果,反应物能够变为生成物,即反应能进行到底,有此类反应的过程和结果特性的反应称之为不可逆反应。
例子B
PD1抗原(CD279)和PD1抗体(如pembrolizumab)在常温常压下反应。
在反应停止时,如果反应环境中CD279的摩尔浓度为200nM, pembrolizumab的摩尔浓度是100nM时,在理想条件下pembrolizumab-CD279复合物的浓度为97.86nM, CD279的摩尔浓度为4.28nM, pembrolizumab为2.14nM;
如果反应环境中CD279的摩尔浓度为100nM, pembrolizumab的摩尔浓度是200nM时,在理想条件下pembrolizumab-CD279复合物的浓度为49.81nM, CD279的摩尔浓度为0.38nM, pembrolizumab为159.19nM。
例子C
PD1抗原(CD279)和PDL1抗原(CD274)在常温常压下反应。
如果反应环境中CD279的摩尔浓度为200nM, CD274的摩尔浓度是100nM时,在反应完成时理想条件下CD274-CD279复合物的浓度为2.35nM, CD279的摩尔浓度为197.65nM,CD274的摩尔浓度是97.65nM;
如果反应环境中CD279的摩尔浓度为100nM, CD274的摩尔浓度是200nM时,在反应完成时理想条件下CD274-CD279复合物的浓度为2.35nM, CD279的摩尔浓度为97.65nM,CD274的摩尔浓度是197.65nM,绝大多数CD279和CD274并未参与反应。
案例B、C两种情况下,无论是抗原和抗体(配体和受体)结合反应,两者反应有生成复合物的正反应过程,也有复合物解离反应生成抗原、抗体逆反应过程,终的结果是抗原,抗体和抗原-抗体复合物三者共存的状态。
这样的反应称之为可逆反应。
当一个可逆反应中正反应和逆反应的速度相等时,反应体系中抗原的浓度、抗体的浓度和抗原-抗体复合物浓度不再增加也不再减少,可逆反应完成,反应体系中各成分摩尔浓度处于动态平衡。
亲和力(Affinity)是可逆反应过程中抗原、抗体和抗原-抗体复合物之间的相对状态的特征参数,其更加专业性和术语化的名称是解离平衡常数KD,单位mol/L(和浓度单位一致)。
亲和力数值越小则亲和力越强,亲和力的强弱决定了终决定反应完成时可逆反应各组分相对多少。
如例子B和C同样是和200nM CD279(PD1)反应,抗体pembrolizumab (PD1抗体)相对于CD279的亲和力为0.4nM, 配体CD274(PDL1)相对于CD279的亲和力为8200 nM,终反应生成的pembrolizumab-CD279复合物是97.86 nM,而CD274- CD279复合物仅仅只有2.35nM,两者相差42倍。
有别于不可逆反应,除了抗原抗体的摩尔浓度外,抗原和抗体(配体和受体)两者间的亲和力将极大的影响可逆反应中生成物的多少。
三、你知道ELISA进行方法学开发时的基本原则吗?
对于亲和力测定方法和原理的概述,读者可参考生物功能学筛选评价技术之亲和力评价篇。
本文主要对饱和浓度法进行概括。
R代表受体或抗原,L代表配体或抗体。
采用饱和浓度法,如果要测定配体相对于受体的亲和力,少量R存在的情况下,将L进行梯度稀释,检测R-L复合物的浓度,当R-L复合物的浓度占总R浓度的一半时,L对应的浓度值(EC50)即L相对于R的KD值。
RL复合物/R即B值可用检测的信号值代替,梯度稀释的L和信号之间的函数关系满足下面的公式,只有在此在特定的实验条件下EC50值能够等价于KD值。
饱和浓度法测定KD值有几个关键点,即相互作用的两个分子,R要少量,L要进行连续的梯度稀释,需要得到的信号响应值(所有的R的结合位点被L占据)即平台期,那么在此条件下,占据一半R时,所需要的L浓度(EC50)为KD值。
饱和浓度法主要测定的是代表RL复合物的信号值,测定方法可以是流式细胞术、同位素标记术、荧光偏振,也可以是ELISA。
四、用于亲和力测定的ELISA方法学开发常用方法
布局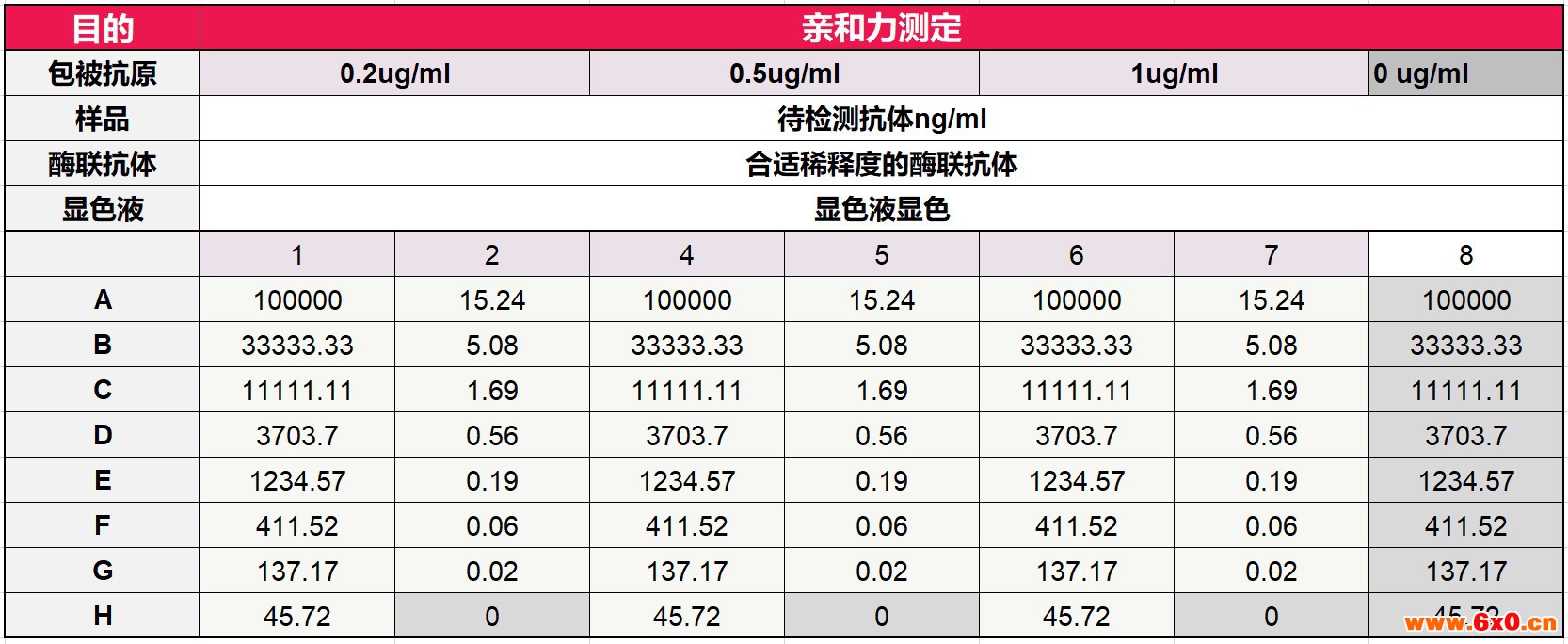
一般操作流程
01 酶标板的制备:取浓度为100 ug/ml抗原,室温溶解,混匀用包被液按如下步骤稀释至0.2ug/ml,0.5ug/ml,1ug/ml,按加样布局表加入100ul/孔,分别加入酶标板条中(Note 1),其中加入包被液做包被抗体的对照,2-8℃过夜;
02用洗涤液洗板3次,拍干,加入300ul/孔封闭液(Note 2)室温封闭1小时;洗涤液洗板3次,拍干待用;
03 按照布局将抗体以100000ng/ml起始3倍梯度稀释(Note 3),按照布局,100ul/孔加入微孔板中;
04放入奥豪斯微孔板振荡器 (ISLDMPHDG)内,设置37℃、600rpm振荡1小时;

05用洗涤液洗板3次,拍干;
06酶联抗体稀释到合适的浓度(Note 4),在奥豪斯涡旋仪(VXMNFS)上混匀,100ul/孔;

07放入微孔板振荡器内,设置37℃、600rpm振荡1小时;
08用洗涤液洗板4次,拍干;
09取酶联抗体对应的显色液,临用前20分钟拿出平衡到室温,在漩涡混合器上混匀;
10使用8道排枪以100 ul/孔加入显色液;
11显色液室温避光放置10-30分钟 (Note 5);
12使用8道排枪以100 ul /孔加入终止液终止反应(根据底物的不同,此步骤可能不需要);
13用酶标仪测定信号值(Note 6);
14结果分析(Note 7)。
贴心小NOTE
Note1:如果需要减少反应过程中高浓度的抗体(100000ng/ml)对酶标板材的非特异吸附,在包被过程中,建议选择疏水性酶标板材(polysorp),包被的抗原浓度需要少量0.2-1ug/ml,具体情况需要根据抗原抗体的亲和力大小来进行判断优化。一般来说亲和力越强,所需的抗原包被浓度越低。
Note2:封闭液不一定能起到封闭效果,需要实验验证(未包被抗原的分组),一般来讲分子量越小的封闭剂效果越佳。
Note3:在方法学开发的初期可以拉大一下标准曲线的浓度范围100000ng/ml-0.1ng/ml,以得到有明显上下平台期的全曲线,当抗原抗体间亲和力较强时,梯度浓度可缩小,稀释的倍数可在方法学优化过程中缩小至2倍。
Note4:酶联抗体效应过量,酶联抗体的稀释需要做不同的稀释度进行比较选择,对于单抗成分的酶联抗体,如果高低两个稀释度的酶联抗体能够产生一样的剂量曲线,说明酶联抗体过量,ELISA的信号传递未产生偏差。
对于多抗成分的酶联抗体,其稀释度的判断较为复杂,可以初略计算下酶联抗体的摩尔浓度要高于包被上的抗原摩尔浓度的5倍以上。当酶联抗体浓度较小时,酶联抗体在高剂量不同浓度的抗体条件下均被抓到,曲线有假上平台。
Note5:对于吸光度值底物和荧光底物,仪器检测的信号值和显色时间成正比,控制在10-30分钟为宜。需要提前确认检测仪器的信号线性范围,比如一般的酶标仪吸光度值的信号线性范围在0-3,吸光度值在3-4之间为非线性的,在显色时应控制信号值不要超过3,当信号值超过线性范围时,曲线有假上平台。
Note6:不同底物需要用不同的仪器进行检测,吸光度读值,荧光读值,化学发光读值。在底物选择过程中注意实验室的酶标仪是否具备该种类型的读数功能。
Note7:标准的剂量曲线拟合一般用四参数拟合,需要有明显的上下平台期(A,D值),斜率一般在0.8-1.2(B值)之间,EC50(C值)即为抗体相对于抗原的亲和力值。
五、总结
根据饱和浓度法,采用ELISA进行亲和力测定时,需要有明显的四参数S型曲线,即需要有随抗体浓度渐进变化的信号曲线。
在抗体低浓度和高浓度时有明显的上下平台期,上平期信号值的一半对应的抗体浓度(EC50)值即抗原抗体间亲和力KD值。
由于仪器的检测信号的线性范围是有限,当信号超过线性范围时会使曲线进入假上平台期使得测得的亲和力不准。
包被的抗原浓度直接决定了信号的信号值,所以在用ELISA进行亲和力测定时,包被的抗原浓度尽量要小,以得到合适的信号值;酶联抗体浓度过低时也可能使曲线进入假平台期。
在ELISA方法学开发过程中,酶联抗体过量以信号的线性传递需要经过实验验证。
当信号无法得到有效的上平台期时,说明抗原抗体间的亲和力太弱或者包被抗原过多,需要更大浓度的抗体才能使得所有抗原被抓住以达到平台期。
受限于ELISA灵敏度的限制,在一些亲和力较弱(>100nM)的抗体抗原中,采用ELISA方法基本得不到有效的平台期,也无法测得的亲和力数值。
ELISA进行亲和力测定评价抗原的活性或者测定抗体活性时,得到的EC50并非越小越好,信号进入假平台期(达到仪器的检测极限,酶联浓度较小)均会使EC50变小,从而得到错误的亲和力数据,这也是ELISA进行亲和力测定时容易产生的谬误。
如今很多抗原蛋白的供应商关于抗原活性的评价均存在此类谬误。
抗原和抗体间的亲和力是有两者的结构和相互作用决定的,可能是0.1 nM,1 nM或者1000 nM。评价ELISA亲和力测定方法的好坏需要看此EC50值是否和亲和力的值相符,亲和力的值可通过热力学测定方法,动力学测定方法和饱和浓度法中的细胞流式测定法等多方面验证。
反过来说当一个ELISA方法不存在诸如信号进入假平台期(达到仪器的检测极限,酶联浓度较小)等谬误时,其EC50值才能真实的反应亲和力的数值。
采用ELISA进行方法学开发需要明确应用目的,大分子定量和亲和力测定。
不同的应用目的,抗原和抗体的相对剂量浓度会有很大的差异,有不同的剂量曲线,读者可以结合上篇《ELISA方法学开发实践版-生物大分子检测的定量方法开发》进行对比研究,明晰差异。
本期分享就到这里啦,我们下期再会哟!
往期文章
奥豪斯助力HPV疫苗国产化进程
关于基因编码的真相 —— 解密 CRISPR
想买实验室摇床的那些人,都在关注什么?
检测那些事儿 | 你的实验仪器又罢工了?
生物药研工作者必备ELISA开发方法
比白血病还可怕的健康杀手——血吸虫病
奥豪斯摇床在血液处理中的应用
想了解奥豪斯的高品质产品吗?请联系我们,留下您的信息,我们的专业工程师将竭诚为您服务!
如要阅读更多精彩文章,欢迎关注微信公众号美国奥豪斯!










 QQ交流群
QQ交流群

