DSS溃疡性结肠炎模型的构建
——急性肠炎动物模型和慢性肠炎动物模型
一、建模背景——DSS造模发展历程
现如今,有多种动物实验模型被广泛用于研究炎症性肠炎(inflammatory bowel disease, IBD)的病因、发病机制及测试新开发药物药效等,尤其以葡聚糖硫酸钠盐(Dextran Sulfate Sodium Salt,DSS)结肠炎(ulcerative colitis,UC)模型应用最广。溃疡性结肠炎动物模型发展历程见图1。
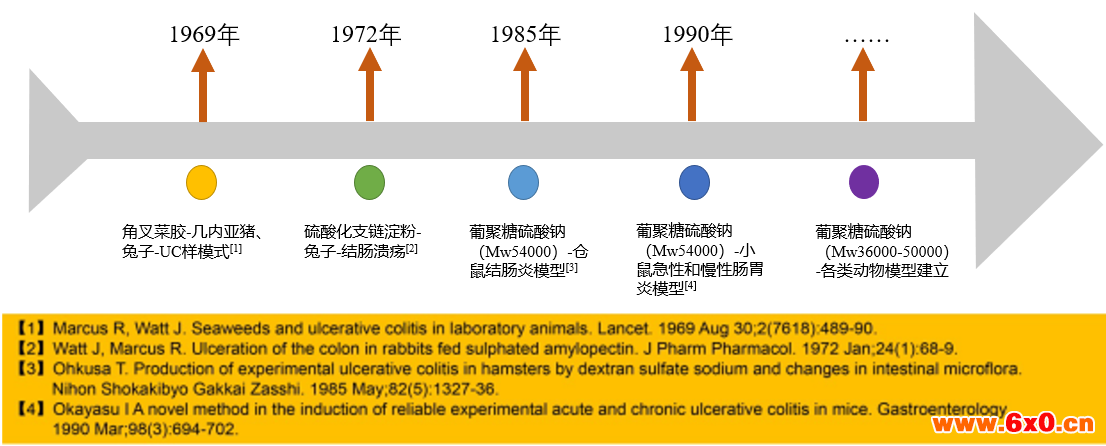
图-1 DSS溃疡病结肠炎模型发展历程
二、DSS溃疡性结肠炎模型的特点
本实验模型使用小鼠、大鼠、仓鼠、豚鼠或猪、兔等动物均可造模,通过给予动物自由饮用不同浓度的DSS水溶液,根据用药时间及用药周期可制成急性和慢性两种结肠炎模型。该模型症状表现与人类UC极为相似,主要表现为腹泻、黏液样便、粪便潜血、肉眼血便、重量减轻、活动度减少,毛色变差等。急性期结肠炎模型和慢性期结肠炎模型组织学改变见表-1。
表-1 DSS结肠炎模型组织学特征 | ||
DSS结肠炎模型类别 | 急性期结肠炎模型 | 慢性期结肠炎模型 |
组织学改变 | 结肠充血、水肿、变短、变脆、重量长度比增加 | 结肠明显缩短 |
出现不同程度的结肠溃疡 | 粘膜增厚、淋巴结肿大 | |
黏膜水肿、杯状细胞缺失、隐窝肿胀破坏 | 杯状细胞缺失、隐窝缺失 | |
黏膜和黏膜下层出现不同程度的炎症细胞浸润,上皮细胞损伤 | 小部分动物出现腺瘤性xi肉、肿瘤样改变 | |
三、 DSS溃疡性结肠炎模型的优势
本实验模型具有诸多优势:
①与人UC极度相似,如症状表现及组织学改变。因此该模型可用于研究急性结肠炎、慢性结肠炎的发生发展机制,也可用于药物的药效研究等,为人UC的实验研究提供借鉴。
②采用自由饮用DSS水溶液的方法建立动物模型,简单易行;模型成功率高,实验重复性强。且造价较低。
③用不同的DSS溶液浓度、给药时间和给药频率,可制成急性和慢性两种结肠炎模型。模型持续时间长,体现了急性向慢性转化的动态过程,解决了UC的慢性化和维持问题,这是以前许多模型无法比拟的。
④已成功在多种属动物中成功造模。
⑤联合氧化偶氮甲烷 (azoxymethane, AOM)用药,可用于诱发结肠炎相关性癌症 (colitis associated cancer, CAC) 动物模型,成功模拟IBD诱发CAC的过程。
四、DSS溃疡性结肠炎模型的建模(以小鼠动物模型为例说明)
实验候选动物:C57BL/6或BALB/c,雌性,6-8周。每组至少8-10只小鼠。
造模试剂:DSS,Mw 36000-50000,含硫量16-20%。
DSS浓度:急性期模型通常为3-5%,慢性期模型通常为1-3%;可根据实验需求及动物类型摸索浓度。该浓度为质量体积比,使用饮用水配置后,过滤除菌。
1. 急性DSS结肠炎模型
Day1:称重并标记各组C57BL/6小鼠。待造模小鼠饮用3-5% DSS水溶液,未处理组小鼠饮用正常水。
Day3:给予待造模小鼠更换新鲜3-5%DSS饮用水。
Day5:给予待造模小鼠更换新鲜3-5%DSS饮用水。
Day8:给予待造模小鼠更换新鲜不含DSS的饮用水。
2. 慢性DSS结肠炎模型
Day1:称重并标记各组C57BL/6小鼠。待造模小鼠饮用1-3% DSS水溶液,未处理组小鼠饮用正常水。
Day3:给予待造模小鼠更换新鲜1-3%DSS饮用水。
Day5:给予待造模小鼠更换新鲜1-3%DSS饮用水。
Day8:给予待造模小鼠更换新鲜不含DSS的饮用水。
Day22-Day26:重复Day1-Day5操作。
Day29:给予待造模小鼠更换新鲜不含DSS的饮用水。
Day43-Day47:重复Day1-Day5操作。
Day50:给予待造模小鼠更换新鲜不含DSS的饮用水。
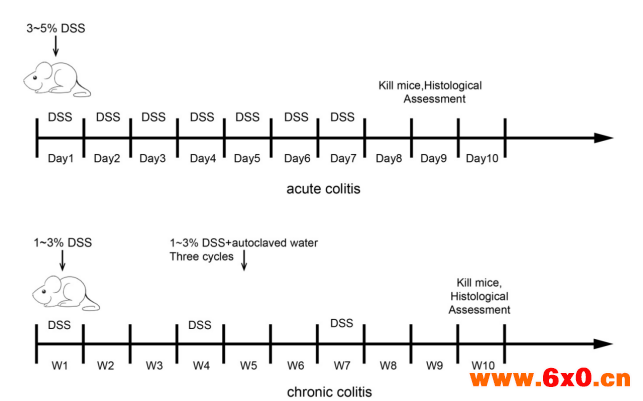
图-2 DSS UC model
3.如何评价造模是否成功?
1). 疾病活跃指数评分 Disease Activity Index, DAI score
从三个方面进行评估打分,分别为体重、粪便粘稠度、粪便潜血等指标,评分细则见表-3。其中,粪便潜血测试可使用尿粪隐血检测试剂盒 (联苯胺法)(Yeasen,60403ES60)。DAI评分为三个指标之和。
表-3 DAI评分细则 | |||
评分 | 体重下降百分比 | 粪便粘稠度 | 粪便潜血 |
0 | 0 | 正常 | 阴性 |
1 | 1-5% | 软便 | 浅蓝 |
2 | 5-10% | 黏液样便 | 蓝色 |
3 | 10-20% | 稀液状便 | 深蓝 |
4 | >20% |
| 肉眼血便 |
2). 组织学变化评分
a) 溃疡形成个数:无—0,1个溃疡—1,2个溃疡—2,3个溃疡—3,>3个溃疡—4
b) 上皮细胞变化:正常—0,杯状细胞缺失—1,杯状细胞大面积缺失—2,隐窝缺失—3,隐窝大面积缺失或息肉状再生—4
c) 炎症浸润:无—0,隐窝周围浸润—1,黏膜肌层出现浸润—2,黏膜肌层普遍浸润,黏膜增厚—3,黏膜下层浸润—4
d) 淋巴结形成:无—0,1个淋巴结—1,2个淋巴结—2,3个淋巴结—3,>3个溃疡—4
组织学变化评分为上述各指标之和,在急性结肠炎模型中淋巴结形成不做评分。组织学分析的标准方法为HE染色(Yeasen, 60524ES60)。
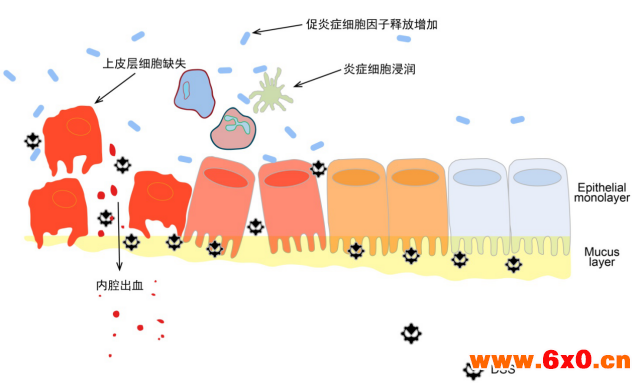
图-3 DSS溃疡性结肠炎组织学变化模拟图
3). 结肠长度
急性结肠炎模型中,第8天可检测到结肠长度缩短;慢性结肠炎模型中,结肠长度缩短更加明显。
4). 总结
DSS UC动物模型构建应先进行预实验,摸索建模条件,建议预实验每组小鼠8-10只,并设立对照组。通常出现体重减轻、稀便、腹泻、血便或粪便潜血、溃疡可视为DSS药物有效,造模成功。
五、建模成功数据及案例分享
目前翊圣葡聚糖硫酸钠盐(DSS)已在市场广泛应用,并取得良好成果。在建模过程中,小鼠的品系以及DSS产品的用药量,可能也是导致建模成功的关键之处,且发现成模时间主要集中在7天左右,效果十分显著。通过对客户实验方案的了解以及数据反馈,将其汇总并分享,详细见下表-4。
表-4 DSS建模成功数据
物种 | 性别 | DSS 浓度 | 给药方 式 | 成模时 间 | 症状 | 成模率 |
小鼠BALB/c | 雌 | 3%-5% | 自饮 | 3天 | 结肠长度缩短、HE染色,炎症明显 | 时短成模高 |
小鼠C57BL/6 | 雌 | 3%-5% | 自饮 | 4天 | 体重下降、便血、拉稀 | 时短成模高 |
小鼠C57BL/6 | 雄 | 3%-5% | 自饮 | 7天 | 体重下降、便血、HE染色,炎症明显 | 时短成模高 |
小鼠C57BL/6 | 雌 | 3%-5% | 自饮 | 6-7天 | 结肠长度缩短、HE染色,炎症明显 | 时短成模高 |
小鼠C57BL/6 | 雄 | 3%-5% | 自饮 | 10天 | 体重下降、便血、拉稀 | 时短成模高 |
小鼠BALB/c | 雌 | 3%-5% | 自饮 | 30天 | 体重下降、便血、拉稀、结肠长度缩短 | 时短成模高 |
大鼠 | 雄 | 3%-5% | 自饮 | 5-7天 | 拉稀、结肠长度缩短、HE染色炎症明显 | 成模率中等 |
DSS结肠炎模型建模成功标准主要从体重、粪便粘稠度、粪便潜血、结肠变化等指标来判断,下图5为大家展示了两组建模成功的结肠切片HE染色:
示例一
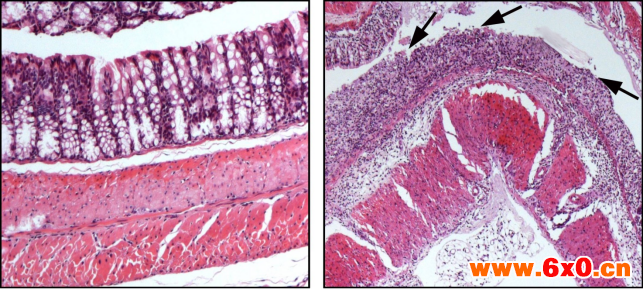
对照组 DSS处理组
示例二
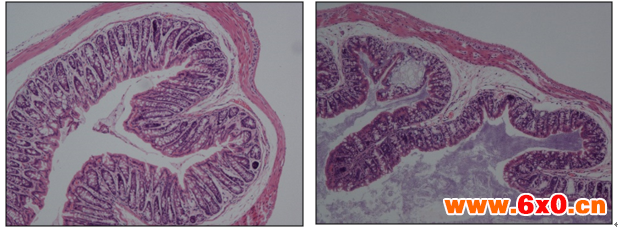
对照组 DSS处理组
图-4 结肠切片HE染色
六、FAQ
无论急性DSS结肠炎模型还是慢性DSS结肠炎模型,肠炎严重程度与成功与否均与小鼠种属(不同基因背景)、DSS浓度、给药周期等相关。常见问题见下表-5。
表-5 DSS结肠炎造模常见问题 | ||
可能的问题 | 可能的原因 | 建议解决办法 |
小鼠致死率高 | DSS浓度太高 | 降低DSS给药浓度 |
小鼠无肠炎症状或低肠炎症状 | DSS浓度太低 | 升高DSS给药浓度;减少循环间隔时间(10-14天) |
同一组小鼠,肠炎症状差异大 | 瓶盖堵塞 | 每天检查小鼠饮水瓶 |
七、相关产品
产品名称 | 货号 | 规格 | 价格(元) |
Dextran Sulfate Sodium Salt(DSS)结肠炎建模用葡聚糖硫酸钠盐 MW:36000~50000 | 60316ES25/60/76/80 | 25/100/500/1000g | 753/1953/7353/13853 |
Urine Fecal Occult Blood Test Kit 尿粪隐血检测试剂盒 (联苯胺法) | 60403ES60 | 100 T | 288 |
Hematoxylin and Eosin Staining Kit 苏木素伊红(H&E)染色试剂盒 | 60524ES60 | 2×100 mL | 358 |
八、相关专题
多研究用途的葡聚糖硫酸 Dextran Sulfate Sodium Salt
不同分子量的葡聚糖Dextran
HB190930










 QQ交流群
QQ交流群

