水质 蛔虫卵的测定 沉淀集卵法
蛔虫卵测定适用范围:
本标准规定了测定水中蛔虫卵的沉淀集卵法。
本校准适用于地表水和废水中的蛔虫卵测定。
当取样体积为10L时,本方法的检出限为5个/10L(注:不锈钢开口直壁容器应选择10L带刻度)
规范性引用文件
本标准内容引用了下列文件或其中的条款。凡是不注明日期的引用文件,其有效版本适用于本标准。
HJ/T 91地表水和污水检测技术规范
方法原理:
沉淀集卵法主要通过样品的浓缩、杂质分离、镜检计数等环节对水中的蛔虫卵进行测定。用60目全不锈钢筛网过滤去除样品中交大的杂质,利用蛔虫卵比重大于水和易于沉淀的特性过夜沉淀浓缩水样,用虹吸的放大弃去上清液,用表面活性剂吐温80作为残液及沉淀转移时的清洗剂,进一步离心浓缩转移的剩余物,收集到的浓缩物用乙酸-乙酸钠缓冲液混匀,控制溶液PH值,获得亲水-亲脂平衡,加入乙酸乙酯吸收水中的脂肪类杂质,使蛔虫卵更容易下沉。再次离心浓缩样品并弃去上部脂肪杂质层级缓冲液层,获得的含卵沉淀层用饱和硝酸钠溶液混匀,于计数框中静置漂浮后镜检,即可测得水样中蛔虫卵的数量。
配套试剂和材料:
分析时请使用符合国家标准的分析纯化学试剂,试验用水为新制备的蒸馏水或者去离子水。
一:乙酸乙酯(C4H8O2)
二:乙酸-乙酸钠缓冲液:PH=4.5
称取15.0g三水合乙酸钠(CH3COONa3H2O) ,溶于约800 ml实验用水中,加入3.6 ml乙酸(CH;COOH)调节pH值至4.5, 用实验用水定容至1000 ml。此溶液保质期为30d。
三:吐温80溶液: q (C24H4O6) =1 %o。
移取1ml吐温80(Tween80),用实验用水稀释定容至1000ml,临用现配。
四:饱和硝酸钠(NaNO3) 溶液
称取略多于实验环境温度对应溶解度的硝酸钠(NaNO3),充分溶解于100g实验用水中,用滤纸滤去残渣,临用现配。硝酸钠在不同温度下的溶解度见附录A。
配套仪器和耗材:
分析时如有量器请使用符合国家标准的A级量器
一:显微镜:物镜4x、10倍,目镜10x倍
二:冰箱:0℃-4℃
三:水平转子离心机:带50ml螺口尖底离心管,离心力1000g以上
四:漩涡混合器
五:筛网:60目 ,孔径250um
六:不锈钢开口直壁容器10L(带刻度
七:开口直壁量筒:1000ml A级
八:虹吸管
九:洗瓶
十:螺口尖底离心管50ml
十一:一次性巴氏滴管3ml、10ml
十二:微移液器:1000ul
十三:定量计数框:1ml网格、5ml型
样品:
按HJ/T 91中对一般污染物采样的要求,用10 L以上容积的塑料桶采样。采样前需用样品荡洗塑料桶,采集样品量应≥10L,常温下运回实验室,立即进行过滤(7.1)和沉淀(7.2)。
分析步骤:
一:过滤
充分摇匀样品,转入不锈钢开口直壁容器至10L刻度。如样品中含有草梗、纸渣等较大杂质,需将样品用筛网过滤,并用吐温80溶液清洗筛网及杂质,洗液并入过滤后的10L样品中。
二:沉淀
上述样品在15 C~25 C室温下静置过夜沉淀12 h~24 h,用虹吸管小心吸取并弃去上清液,避免扰动,保留1 L含沉淀物的样品,转入1000 ml开口直壁量筒,分别用50 ml吐温80溶液彻底清洗不锈钢开口直壁容器3次,洗液并入开口直壁量筒。在15 C~25 C室温下再次静置过夜沉淀12h~24h,用虹吸管吸取并弃去上清液,避免扰动,保留90 ml~ 100 ml含沉淀物的样品。
注1:若样品中蛔虫卵浓度在10倍检出限以上(>50个/10L),采样时,可只采总量不小于1L的样品,取1L水样直接进行第二步的量筒沉淀浓缩。当样品中含有草梗、纸渣等较大杂质,同样应先将样品用筛网过滤,并用吐温80溶液清洗筛网及杂质,洗液并入1 L样品中沉淀。
离心:
沉淀浓缩后的样品(7.2) 小心转移至3个螺口尖底离心管,分别用15 ml 吐温80溶液彻底清洗开口直壁量筒3次,洗液均匀并入3个螺口尖底离心管。以1000g 的离心力(离心机转速计算见附录A)离心15 min,用巴氏滴管小心吸取并弃去,上清液,少量留之,避免带出沉淀。
用少量吐温80溶液将3个离心管中的沉淀进行悬浮,将沉淀量少的2个离心管中的悬浮液并入沉淀量最多的一个离心管中:分别用3 ml~ 5 ml吐温80溶液彻底清洗被转移悬浮液的2个离心管,每支清洗3次,确保没有沉淀被丢弃,洗液并入沉淀量最多的离心管。以1000g的离心力离心15min, 用巴氏滴管小心吸取并弃去上清液,少量留之,避免带出沉淀。
脂类杂质分离去除:
用与离心后沉淀等体积的乙酸-乙酸钠缓冲液对沉淀进行悬浮(即:离心后沉淀体积为2 ml,加入2ml缓冲液。如果离心后沉淀体积不足2ml,加入缓冲液至4 ml。以确保用乙酸乙酯浸提后,沉淀上方有足够体积的缓冲液,便于脂类杂质层完全倾出,且避免蛔虫卵沉淀层的丢失。
加入2倍离心后沉淀体积的乙酸乙酯,用涡旋混匀器完全混合。以.1000g的离心力离心15 min, 样品被分为清晰的三层。所有的非脂肪物质、重碎片,包括蛔虫卵、幼虫和原生动物在底层;中间层是缓冲液层;脂肪和其他脂溶性物质在上方形成黑而厚的一层。
将上层和中间层液体平稳倾出弃去,记录底层沉淀体积。如有必要,可用细针在离心管壁四周对上层的脂肪层进行松动。
镜检:
加入5倍底层沉淀(7.4)体积的饱和硝酸钠溶液,对分离去除脂类杂质后的含卵底层沉淀进行悬浮。该悬浮液可置于0 C~4 C冰箱冷藏保存,备检,于1周内检测完毕,检测时需将其静置至室温。充分摇匀悬浮液,将其转入定量计数框静置5 min,在显微镜下计数,直至全部悬浮液镜检完成。分别用1 ml饱和硝酸钠溶液充分洗涤镜检完的离心管3次,将洗液转入定量计数框,按以上步骤镜检。所有检测到的蛔虫卵全部计数。
镜检时,需保持环境条件的稳定,无震动和风扰,缓移计数框,自上而下“U”型逐列计数。蛔虫卵鉴定方法见附录B。
空白对照试验:
取10L同批次试验用水,按以上采样及分析步骤进行全程序样品的测定。
结果计算于表示:
计算结果:
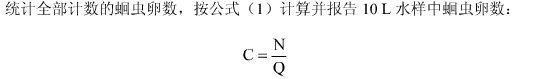
C------水样中蛔虫卵浓度(个/10L)
N-----检测到的所有蛔虫卵数(个)
Q-----实际水样体积(10L)
结果表示:
水质中蛔虫卵的测定,实验最终结果取整数,以“个/10L”为单位
精密度:
6家实验室分别对实际样品和低浓度(20 个/10L)、中浓度(40 个/10L)、高浓度(80个/10L)自配样品的蛔虫卵进行测定,实验室内相对标准偏差范围分别为:6.5%~18.9%,10.1%~22.0%,12.8%~23.8%, 8.9%~ 17.4%;实验室间相对标准偏差分别为5.8%、5. 5%、4.9%、4.8%; 重复性限(个/10L)为244、3、7、11;再现性限(个/10L)为260、3、7、11。
质量保证和质量控制:
每批次样品至少做1个全程序空白实验,并取10%的样品进行平行样测定,全程序空白实验不得检出蛔虫卵,平行样间的相对偏差不得超过30%。
废物处理:
实验中虹吸液煮沸10min后可按普通废弃物处理,含乙酸乙酯的废弃液应集中保管,委托有资质的单位进行处理。
注意事项:
实验用过的器具均需进行高温灭活,置于水中煮沸10min后方可再次使用。
实验操作人员要注意自身防护,试验时要穿戴工作服、乳胶手套、及口罩等,同时还要避免蛔虫卵的样品污染实验室环境。
附录A
硝酸钠水中溶解度、离心机离心力及转速计算公式
A.1 硝酸钠在水中的溶解度
表A.1 硝酸钠水中溶解度
温度(℃) | 溶解度(g) |
0 | 73 |
10 | 80 |
20 | 87 |
30 | 95 |
40 | 103 |
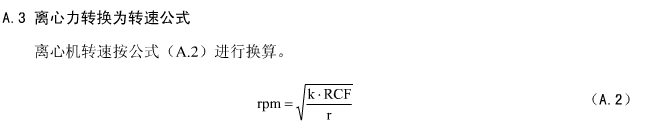
A.2离心力计算公式:



附录B
蛔虫卵的检定
B.1蛔虫卵的形态特征
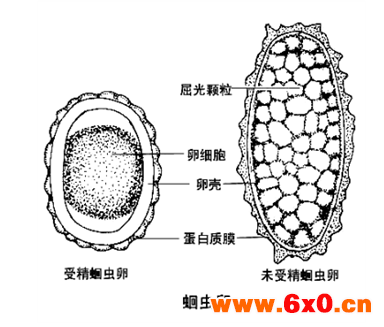
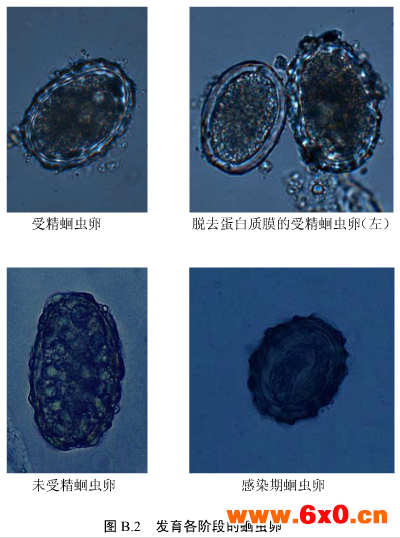
B.1.1受精蛔虫卵
虫卵呈短椭圆形,大小为45 μm~75 μmx35 μm~ 50 μm。卵壳很厚,自外向内分为三层:受精膜、壳质层和蛔甙层,壳质层较厚,另两层极薄,在普通显微镜下难以分清。卵壳内有一个大而圆未分裂的受精卵细胞,与卵壳间常见有新月形空隙。卵壳外有一层由虫体子宫分泌形成的蛋白质膜,其表面凹凸不平呈波浪状。随粪便排出的虫卵常被胆汁染成黄色或棕褐色。
B.1.2未受精蛔虫卵
虫卵呈长椭圆形或不规则形,大小为88 μm~94 μmx39 μm ~44 μm,卵壳与蛋自质膜均较受精蛔虫卵薄,淡黄色,无蛔甙层,卵壳内含有许多大小不一的屈光颗粒。
B.1.3感染期蛔虫卵
卵内含有一.条卷曲的幼虫。
B.1.4蛋白质膜脱落的蛔虫卵
若蛔虫卵的蛋白质膜脱落,卵壳则呈无色透明,应注意与其他线虫卵的鉴别。
B.2蛔虫卵参考图片
B.2.1蛔虫卵模式图

B.2.2发育各阶段的蛔虫卵

附录C
蛔虫卵配置样品的制备
猪蛔虫(Ascaris suum)活成虫采集自屠宰场,用蒸馏水洗涤干净后,放置于含4 %甲醛溶液内,0 C~4 C保存备用,可长期保存。
制备蛔虫卵备用液时,选取2~3条雌性蛔虫,用75 %乙醇消毒过的解剖刀,划开虫体,每条蛔虫一- 对子宫选取靠近阴门的一段(2 mm~3 mm),解剖后,将含蛔虫卵的内容物及组织碎片放入50ml离心管中,加入数颗直径1mm玻璃珠及10ml生理盐水,混匀后于涡旋混匀器振荡3min~5min,用260目网过筛,取40ml生理盐水分数次冲洗离心管和筛网,此时获得的滤液中蛔虫卵呈单个状态存在。滤液加入甲醛至终浓度为4%,0 C~4 C保存备用,可保存1个月。即制即用时可不添加甲醛。
制备配制样品时,摇匀蛔虫卵备用液,用1000 μ1微量移液器,立即吸取适量的蛔虫卵备用液于1ml定量计数框(网格)中,计数后用250μl微量移液器向计数框中添加或移出蛔虫卵至所需数量。将计数框中所有的液体用吐温80溶液冲洗入配制样品中。再在显微镜下检测计数框,确保无蛔虫卵残留。










 QQ交流群
QQ交流群

