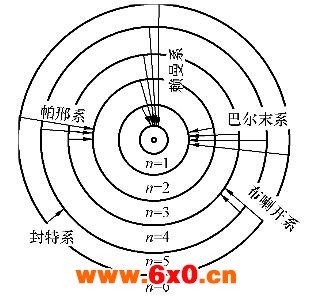
为了对原子光谱与原子结构间的内在联系有一个形象化的理解,以氢原子为例,用图示的方式说明原子结构和原子光谱的关系。
根据玻耳的假定和量子化条件,氢原子在不同的轨道上运动,其能量是不相同的。在正常情况下,它处于能量最低的n=1的轨道上。当原子受到辐射或高能粒子的碰撞等外界因素作用时,就吸收一定的能量而跃迁到某一个能量较高的状态上去。处于激发态的原子是不稳定的,电子能自发地过渡到能量较低的轨道,同时发出一个能量为hv光子,其波数可由式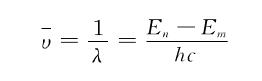 算出。原子从不同的较高能量的状态,过渡到同一能量较低的状态时所发生的单色光同属于一个线系。例如,从n=2,3,…轨道过渡到n=1的轨道所发射的谱线属于赖曼系;从n=3,4,…轨道过渡到n=2的轨道所发射的谱线属于巴尔末系,以此类推,见图。一个激发到第3玻耳轨道的电子,可以先从的轨道过渡到n=2的轨道,放出巴尔末系的第1条谱线,然后过渡到n=1的轨道,放出赖曼系的第一条谱线,也可以直接过渡到n=1的轨道,1个氢原子只能放出1条谱线,许多氢原子处于不同的激发态才能发出不同的谱线,通常在实验中都存在的大量不同能量的激发态原子,故可以同时观察到其全部发射光谱。
算出。原子从不同的较高能量的状态,过渡到同一能量较低的状态时所发生的单色光同属于一个线系。例如,从n=2,3,…轨道过渡到n=1的轨道所发射的谱线属于赖曼系;从n=3,4,…轨道过渡到n=2的轨道所发射的谱线属于巴尔末系,以此类推,见图。一个激发到第3玻耳轨道的电子,可以先从的轨道过渡到n=2的轨道,放出巴尔末系的第1条谱线,然后过渡到n=1的轨道,放出赖曼系的第一条谱线,也可以直接过渡到n=1的轨道,1个氢原子只能放出1条谱线,许多氢原子处于不同的激发态才能发出不同的谱线,通常在实验中都存在的大量不同能量的激发态原子,故可以同时观察到其全部发射光谱。
氢原子是所有元素的光谱中最简单的光谱,在可见光区,它的光谱只由几根分立的线装谱线组成,其波长和代号见下表。
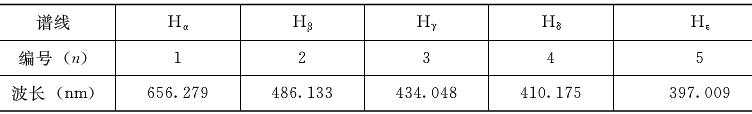
不难发现,从红到紫,谱线的波长间隔越来越小,n>5的谱线密得用肉眼几乎难以区分。
以上是关于氢原子的能级,电子较多的其他原子的情形与之基本相同,当然这些原子中具体情况要复杂的多,为了分析方便,常用不同高低的水平线表示不同的原子能量,用把两个能级连接起的线表示这两个能级之间发生跃迁时所辐射的谱线。










 QQ交流群
QQ交流群

